Gastrofísica
11 experimentos-receta relacionados con la cocina, explicando un principio físico presente
Índice
1. Newtoniano o no newtoniano
⏱️ Tiempo de preparación
De 30 min a 1 h.
🧑🎓 Nivel
Educación Primaria y Secundaria.
⚠️ Precauciones
Se recomienda supervisión.
🧑🍳 Ingredientes
- Maicena
- 1 bol de agua
- 1 bol para mezclar
- 1 bote de miel
- 1 cucharilla
📋 Instrucciones
- Pon 60 mL de maicena en el bol.
- Añade 30 mL de agua a la mezcla.
- Remueve la mezcla y poco a poco, añade otros 30 mL de agua hasta que toda la maicena se haya disuelto.
- Coge el bol de agua, el de mezcla de maicena y agua y el bote de miel y golpea con una cuchara la superficie de los tres líquidos. ¿Reaccionan igual? ¿Qué diferencias observas?
- Si cuentas con supervisión, calienta la miel y reporta si aprecias cambios en sus propiedades.
- Después de explorar un poco la bibliografía… ¿Cuáles de estos líquidos son newtonianos? ¿Qué diferencia los unos de los otros?
📖 Bibliografía y otros recursos
- http://www.scifun.org/HomeExpts/lumpyliquids.htm
- https://link.springer.com/chapter/10.1007/978-1-4419-6494-6_1
🧑🏫 Explicación
Imagina que intentas atravesar una acera llena de gente. La manera más sencilla de atravesarla es yendo despacio, buscando en cada momento los huecos por los que colarse. Si intensases ir muy rápido, chocarías con alguien y no llegarías muy lejos. Esto es algo muy parecido a lo que ocurre en la mezcla de maicena y agua: presionando suavemente con el dedo permites a las moléculas de maicena apartarse poco a poco sin apelotonarse, pero al tratar de introducir el dedo o la cucharra rápidamente (con un golpe) las moléculas evitan el paso de la cuchara, convirtiendo la mezcla en un sólido durante un corto instante de tiempo.
Utilizamos el término viscosidad para describir la resistencia de un líquido a fluir (esto es, a apartarse del camino de las cosas que lo intentan atravesar). Para la mayoría de los líquidos, como son el agua o la miel, la viscosidad depende de la temperatura. Estos líquidos son llamados newtonianos dado que fueron estudiados por Sir Isaac Newton, uno de los primeros físicos de la historia. La mezcla de maicena que acabas de hacer es un fluido no newtoniano, ya que su densidad depende no sólo de la temperatura sino también de la velocidad del objeto que la intenta atravesar.

Otros ejemplos de fluidos no newtonianos son el kétchup, el slime, la lava y las arenas movedizas. Es por eso que la mejor manera de salir de unas arenas movedizas es manteniendo la calma y poco a poco tratando de salir de ellas… ¿Quién dijo que la gastrofísica no podía salvarte la vida?

2. Lluvia arcoíris
⏱️ Tiempo de preparación
De 30 min a 1 h.
🧑🎓 Nivel
Educación Primaria y Secundaria.
⚠️ Precauciones
Se recomienda supervisión.
🧑🍳 Ingredientes
- 1 bote transparente
- 1 taza
- 1 L de agua
- 250 mL de aceite
- Colorante alimenticio a base de agua
📋 Instrucciones
- Coge los 250 mL de aceite y mézcalos con tu color favorito de colorante alimentario. Puedes mezlar varios colores para crear un efecto más vistoso. ¿Qué observas?
- Rellena 3/4 del volumen del bote con agua.
- Pon la mezcla de colorante y aceite en el agua. ¿Qué ocurre? ¿Flota o se hunde? ¿Por qué?
- Espera y observa lo que ocurre. Describe el fenómeno y trata de darle una explicación.
📖 Bibliografía y otros recursos
🧑🏫 Explicación
El aceite y el agua no pueden mezclarse, lo cual hace del aceite una sustancia hidrófoba. Hidrófobo es un término que viene del griego antiguo ὑδρόφόβος (hýdrophóbos), “que tiene miedo al agua”. Por otro lado, el colorante alimenticio se mezcla genial con el agua por lo que nos referimos a él como una sustancia hidrófila, que viene del griego antiguo φίλυδρος (hýdrophílos), “que le gusta el agua”. Esta particularidad hace que el colorante alimentario (que es hidrófilo por estar hecho de agua) se mezcle heterogéneamente con el aceite agrupándose dentro de él en pequeñas gotitas que por mucho que remuevas nunca se disolverán del todo.

Las interesantes propiedades de las sustancias hidrófobas e hidrófilas son uno de los pilares que hacen posible la existencia de vida tal y como la conocemos sobre la faz de la Tierra. Nuestras células (y las del resto de los seres vivos) mantienen los componentes de su citosol dentro de sí mediante una doble capa lipídica constituida en su mayor parte por moléculas muy similares a las que forman el aceite.
Cuando se ponen en el agua, el colorante contenido en estas gotitas se desplaza hacia abajo por acción de la gravedad ya que, el colorante, al igual que el agua que lo forma, es más denso que el aceite. Una vez las gotitas de colorante entran en contacto con el agua, al ser éstas hidrófilas, se disuelven en ella sin problema creando el efecto de la lluvia de arcoíris. ¿No es genial?
3. Lágrimas de vino
⏱️ Tiempo de preparación
De 2 h a 3 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Se recomienda supervisión.
- Se usarán bebidas alcohólicas.
🧑🍳 Ingredientes
- 2 copas de vino.
- Vino.
- Agua.
- Una linterna.
- 1 hoja de papel.
- 1 cámara de vídeo (optativo).
📋 Instrucciones
- Pon algo de vino en la copa (menos de 100 mL está bien).
- Agita la copa con estilo y cuidado.
- Coloca un folio en blanco detrás de la copa de vino (por ejemplo, en una pared).
- Ilumina la copa de vino con la linterna y observa la sombra que proyecta sobre el papel. ¿Puedes ver las gotas de vino caer?
- ¿Cuánto les cuesta a las copas de vino llegar al fondo? ¿Observas algo extraño en su dinámica?
- Repite el experimento usando agua. ¿Cuál es la diferencia con el vino?
- ¿Por qué crees que son diferentes? ¿Qué distingue el agua del vino?
- Optativo: puedes grabar el experimento con una cámara y reproducir el vídeo a alta velocidad para apreciar la dinámica más claramente.
📖 Bibliografía y otros recursos
🧑🏫 Explicación
En la macroescala, la dinámica de los fluidos está dominada por presiones, corrientes y demás. Sin embargo, a escalas más pequeñas la física de los fluidos cambia. Por ejemplo, en la pequeña escala (alrededor de los milímetros) la tensión superficial de los fluidos es un factor clave a tener en cuenta. Esto es lo que les permite a algunos insectos caminar por el agua y a ti no (es una cuestión de tamaño).
Uno de los efectos de la tensión superficial es que hace que la superficie de un fluido se doble un poco al ser puesto dentro de una copa de vidrio. Cuanto más estrecha es la copa, más apreciable es la curvatura que se observa (llamada menisco). Un factor importante que influye en la tensión superficial es la composición molecular del fluido. El etanol, por ejemplo, tiene una tensión superficial menor que la del agua. He aquí la razón de usar una bebida alcohólica en el experimento.
 de agua coloreada. Fuente: https://commons.wikimedia.org/wiki/File:Meniscus.jpg.](/blog/2022/04/24/gastrofisica/menisco_hu440825ba1732828148554f52c315debe_258844_7070722d1a302a78b9b433bb490a4b7e.webp)
Como dijimos antes, la superficie de un fluido dentro de una copa se curva en forma de “U”. Esta columna de fluido cercana al vidrio se sostiene gracias a la fuerza de la tensión superficial. Una diferencia importante entre la columna de fluido sostenida por la tensión superficial y el resto de la copa es que la columna es más estrecha y, por lo tanto, más fácil de evaporar. Las moléculas de etanol (alcohol) presentes en dicha columna se evaporan más rápido que las de agua reduciendo la concentración de alcohol presente en ella e incrementando la tensión superficial.
Con el aumento de la tensión superficial, la columna de vino asciende un poquito hasta que alcanza una masa crítica que la gravedad fuerza a caer originando la aparición de las lágrimas de vino sobre la copa. Pese al dramático nombre del efecto, aseguramos que tras este experimento el vino no está triste en abosoluto.

4. Desviación de un chorro de agua
⏱️ Tiempo de preparación
De 30 min a 1 h.
🧑🎓 Nivel
Educación Primaria.
⚠️ Precauciones
Se recomienda la supervisión de un adulto.
🧑🍳 Ingredientes
- 1 globo.
- Agua.
📋 Instrucciones
- Infla el globo.
- Abre ligeramente el grifo de la cocina. Debe crear un chorro transparente, sin burbujas y no demasiado grueso.
- Aproxima el globo de plástico al principio del caudal de agua. ¿Sucede algo?
- Frota el globo contra tu cabeza. Repite el paso 3. ¿Qué observas?
- A partir de los resultados anteriores, ¿a qué crees que se debe el efecto observado?
📖 Bibliografía y otros recursos
🧑🏫 Explicación
Cuando frotamos el globo, éste recoge cargas negativas, adquiriendo alguna carga total. Gracias a Coulomb, sabemos que las cargas negativas ejercen una fuerza de repulsión sobre las negativas y de atracción sobre las positivas, como puedes comprobar con esta excelente simulación:
El agua del grifo tiene disueltos iones (calcio, magnesio y otros minerales) que son positivos. Esto hace que el agua tenga cierta carga positiva. Cuando el chorro cargado positivamente se coloca cerca del globo, éste es atraído por sus cargas negativas, de ahí la curvatura.
¿Este efecto es causado sólo por los minerales disueltos en el agua? No. Si repetimos el experimento con agua destilada, deberíamos ver la curvatura. Esto se debe a la autoionización del agua. Las moléculas de H2O del agua se disocian espontáneamente en iones H+ positivos y OH– negativos… ¡por eso el agua tiene un pH distinto de cero! El pH es sólo una forma de contar los H+ positivos que hay. Por supuesto, al tener el mismo número de cargas positivas que negativas, el agua destilada sigue teniendo una carga neutra.

Fuente: https://commons.wikimedia.org/wiki/File:Autoionizacion-agua.gif
Sin embargo, cuando colocamos el globo cargado negativamente cerca de la corriente, los iones negativos son repelidos, y regresan a través de la corriente, dejando caer una corriente cargada positivamente, llena de iones de hidrógeno. De nuevo, estos iones son atraídos por el globo, y la corriente se dobla. ¡Este efecto fue utilizado por Lord Kelvin para construir un aparato genial que genera chispas a partir de agua!
 en 1867, expuesta en el [SPARK Museum of Electrical Invention](https://en.wikipedia.org/wiki/SPARK_Museum_of_Electrical_Invention), en Bellingham, Washington, Estados Unidos. Fuente: https://commons.wikimedia.org/wiki/File:Kelvin_water_dropper_electrostatic_machine_model.jpg](/blog/2022/04/24/gastrofisica/generador-Kelvin_hu237e37f4ac1acb69ba73dce6714e4248_210720_2652ed57aa1fea56aeb7c493a47ba881.webp)
PD: Este efecto se utiliza a veces para argumentar que las moléculas de agua tienen un momento dipolar. Este experimento no demuestra esto en absoluto. El campo creado por el globo es débil, por lo que la molécula estará en un campo aproximadamente uniforme, y los dipolos en campos uniformes no se desplazan, sino que giran.
5. Efecto Leidenfrost
⏱️ Tiempo de preparación
De 2 h a 3 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Se requiere supervisión.
- Se emplearán superficies calientes.
🧑🍳 Ingredientes
- Agua.
- Etanol 98 %.
- Jeringuilla.
- Sartén.
📋 Instrucciones
- Pon la sartén en el fuego y pon unas gotas de agua (o etanol) con la jeringa mientras se calienta. Después de unos minutos las gotas desaparecen. ¿Por qué?
- Ahora, deja que la sartén se caliente durante 5 minutos. Una vez está caliente, pon un poco de agua (o etanol). ¿Qué observas? ¿Es diferente a lo que observaste antes?
- Intenta observar este último efecto con diferentes líquidos (por ejemplo, agua y etanol a diferentes concentraciones) y diferentes tamaños de gota.
📖 Bibliografía y otros recursos
🧑🏫 Explicación
Cuando se derrama una pequeña cantidad de líquido sobre una superficie considerablemente más caliente que su punto de ebullición, el tiempo de evaporación aumenta. Por lo tanto, la vida útil de la gota se alarga. Esto se conoce como el efecto Leidenfrost. El fundamento físico del efecto Leidenfrost reside en la capa de vapor que se crea bajo la gota. Esta capa sostiene la gota y la aísla de la superficie caliente.
La formación y el comportamiento de la capa dependen de muchos parámetros, tanto del líquido como de la rugosidad de la superficie. Dada esta complejidad, no es fácil predecir las condiciones exactas en las que se observa el efecto Leidenfrost.
6. Corrientes de convección y difusión
⏱️ Tiempo de preparación
De 2 h a 3 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Se recomienda supervisión.
- Uso de agua caliente.
🧑🍳 Ingredientes
- 3 tazas.
- Colorante (dos colores).
- Bandeja de horno transparente.
- Agua.
📋 Instrucciones
- Llena la bandeja del horno con agua.
- Llena dos tazas de agua fría y la tercera con agua caliente. La temperatura del agua fría debe ser como la del frigorífico. El agua caliente debe estar lo suficientemente caliente para observar vapor saliendo de la taza.
- Coloca la bandeja sobre las tazas. Para ello, coloca las tazas frías en los extremos y la taza caliente en el centro.
- Pon unas gotas de colorante alimentario (suficientes para crear una mancha visible) en el centro de la bandeja (sobre la taza caliente). Crea otras dos manchas de otro color sobre las frías.
- Observa la bandeja desde un lado. ¿Qué ves? Si quieres mejorar el efecto, graba todo con una cámara/smartphone y luego acelera la grabación.
- ¿Durará este efecto para siempre? Si no, ¿qué lo hará parar?
- Pon algunas gotas de colorante alimenticio en la taza caliente y la misma cantidad en la de agua fría.
- Algunos de los puntos o manchas crecen más rápido que otros. ¿Por qué?
📖 Bibliografía y otros recursos
-
-
http://hyperphysics.phy-astr.gsu.edu/hbasees/thermo/heatra.html#c1
-
http://hyperphysics.phy-astr.gsu.edu/hbasees/Kinetic/diffus.html#c2
🧑🏫 Explicación
La densidad de un líquido se define como la relación entre su masa y el volumen que ocupa. La densidad es una variable importante en la mecánica de fluidos porque puede determinar la posición de los fluidos: los menos densos tienden a fluir por encima de los fluidos más densos. Esto es lo que ocurre cuando intentamos mezclar aceite y agua: la densidad del aceite es menor que la del agua, por lo que el aceite “flota” sobre el agua.
 / [CC BY](https://creativecommons.org/licenses/by/3.0)](https://upload.wikimedia.org/wikipedia/commons/thumb/7/71/Artsy_density_column.png/207px-Artsy_density_column.png)
Kelvinsong / CC BY
Un mismo fluido puede tener diferentes densidades si cambiamos la temperatura. Cuando la temperatura aumenta, la vibración de las moléculas del fluido también lo hace, haciendo que el líquido ocupe un mayor volumen. Recuerda: la densidad es la relación entre la masa y el volumen, como la masa no ha cambiado y el volumen ha aumentado, ¡la densidad es menor! En resumen: los líquidos calientes son menos densos que los fríos.
Esta diferencia causada por la temperatura da lugar a un fenómeno muy importante en física: la convección. Imagina una olla llena de agua y colocada sobre el fuego. El fondo de la olla, que está en contacto directo con el fuego, estará más caliente que la superficie del agua, en contacto con el aire. Esto hace que el agua del fondo esté más caliente que la de la superficie y, por tanto, sea menos densa. Como el agua caliente es menos densa, empezará a fluir hacia arriba, y viceversa para el agua fría de la superficie.
Cuando el agua fría llega al fondo, empieza a calentarse. Mientras tanto, el agua caliente que ha llegado a la superficie empieza a enfriarse. Por esta razón, el agua fría del fondo empieza a calentarse y a ser menos densa, y el agua caliente de la superficie se enfría y es más densa. De nuevo, el agua (ahora) caliente quiere fluir hacia arriba, hacia la superficie, y el agua (ahora) fría quiere fluir hacia abajo, hacia el fondo. Tenemos un movimiento cíclico.
 dada una fuente de calor. Fuente: https://commons.wikimedia.org/wiki/File:Convection.gif.](/blog/2022/04/24/gastrofisica/conveccion.gif)
Esto es lo que podemos ver en nuestro experimento. El fenómeno de la convección es una de las formas de transmisión del calor, y tiene una enorme relevancia en las corrientes de agua del mar, ¡e incluso en el plasma de una estrella! La convección está en todas partes, y ahora también en tu cocina.

Explicación adicional
Un aspecto importante de la explicación anterior es el hecho de que el calor hace que las moléculas se muevan más rápido. Cuando el colorante se coloca en agua fría las moléculas se mueven lentamente, por lo que la difusión es lenta. Cuando se coloca en agua caliente, las moléculas se mueven más rápido, por lo que pueden ocupar un mayor volumen en menos tiempo. El mecanismo de difusión es importante en las células y en el diseño de fármacos para la industria farmacológica, ya que determina la velocidad a la que puede desplazarse una sustancia cuando el fluido donde se coloca está en reposo.

Explora el mecanismo de difusión con esta excelente simulación:
7. Falsa transición de fase en huevos
⏱️ Tiempo de preparación
De 1 h a 2 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Comprueba las intolerancias alimenticias asociadas a los huevos.
- El uso de etanol requiere supervisión.
🧑🍳 Ingredientes
- 4 huevos.
- 1 olla pequeña.
- 1 batidor de varillas.
- 0.5 L de etanol.
- 1 L de agua.
- 1 termométro.
- 1 sal.
📋 Instrucciones
- Rompe el huevo y estudia sus propiedades mecánicas y ópticas. ¿Cuál es su estado de fase?
- Calienta el agua controlando su temperatura con el termómetro. ¿A qué temperatura empieza a hervir? ¿Cambia la temperatura desde el momento en que empezó a hervir?
- Pon el huevo en agua y espera durante 15 minutos.
- Rompe el tercer huevo en un vaso transparente y cúbrelo de etanol. Espera unos minutos. ¿Qué ocurre?
- Separa la yema y la clara del cuarto huevo. Añade un poco de sal y bate vigorosamente la clara con el batidor de varillas. ¿Qué ves?
- ¿Son reversibles estos cambios en las propiedades mecánicas y ópticas del huevo?
- ¿Qué puedes decir sobre la reversibilidad del cambio en las propiedades mecánicas y ópticas del agua que está en la olla?
📖 Bibliografía y otros recursos
https://www.exploratorium.edu/food/explorable-water-drop
🧑🏫 Explicación
En el caso del agua, observamos cómo el líquido se convierte en gas a partir de una determinada temperatura (la de ebullición, en torno a los 100 °C). Esto es lo que llamamos transición de fase. En este caso, las dos fases son la de líquido y la de gas, que por supuesto tienen propiedades muy diferentes (por ejemplo, los gases pueden comprimirse, pero la mayoría de los líquidos no). Pero… ¿Por qué vemos un cambio, si siempre es agua (un montón de moléculas de H2O) lo que estamos calentando? Efectivamente, tanto el vapor como el agua líquida no son más que un montón de moléculas de H2O, pero la diferencia radica en cómo se ordenan estas moléculas en el espacio. En el caso de los gases, las moléculas pueden moverse libremente, mientras que en los líquidos se mantienen unidas por enlaces débiles (que empiezan a romperse cuando aumentamos la temperatura). Por eso vemos un cambio en las propiedades: cada fase está relacionada con una disposición determinada.
Puedes conocer mejor las propiedades de los estados de agregación con la siguiente simulación:
En el caso de la clara de huevo, también observamos grandes diferencias en las propiedades físicas: los cambios de color (propiedades ópticas), y también su consistencia (propiedades mecánicas). ¿De qué está hecha la clara de huevo? La clara de huevo es una mezcla de aproximadamente un 90 % de agua y un 10 % de proteínas (moléculas muy largas). Cuando la clara de huevo es más líquida y transparente, las proteínas que la componen se encuentran ordenadas. Sin embargo, como has visto, podemos perturbar este orden por varios medios: térmicamente (utilizando el agua hirviendo), químicamente (utilizando etanol) y mecánicamente (batiendo). Todas estas perturbaciones hacen que las proteínas empiecen a enredarse (¡como los auriculares en un bolsillo!). Este enredo cambia las propiedades mecánicas y ópticas de la clara del huevo, lo que conduce de nuevo a una transición de fase.
 de la clara de huevo se desnaturaliza y pierde solubilidad cuando se cocina el huevo. (Abajo) Los clips proporcionan una analogía visual para ayudar a conceptualizar el proceso de desnaturalización. Fuente: https://commons.wikimedia.org/wiki/File:Protein_Denaturation.png.](/blog/2022/04/24/gastrofisica/desnaturalizacion-proteinas_hu60c2896d6bbe308e4f1347030c94f559_154694_908235911ad5209e2676511313d620a6.webp)
Como ves, no son sólo los componentes químicos de la materia los que determinan las propiedades de algo, sino también su disposición. ¿Se te ocurre algún otro ejemplo?
8. Lentes de gelatina
⏱️ Tiempo de preparación
De 2 h a 3 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Necesita supervisión.
- Uso de láseres.
- Uso de cuchillo y tijeras.
🧑🍳 Ingredientes
- Gelatina transparente.
- Agua.
- 1 cuchillo.
- 3 punteros láser.
- 3 bridas.
- 1 hoja de papel.
- Lámina o funda de plástico.
- 1 vaso de plástico.
- Tijeras.
📋 Instrucciones
- Prepara la gelatina. Procura añadir 3/4 del agua requerida por las instrucciones.
- Utiliza las tijeras para cortar el borde del vaso de plástico.
- Una vez se haya cuajado la gelatina, corta tres rectángulos usando el cuchillo.
- Aprieta el vaso de plástico para hacer un óvalo. Luego utilízalo para cortar uno de los rectángulos y obtener una lente convergente de gelatina.
- Utiliza el exterior del vaso de plástico para cortar una lente divergente de otro rectángulo de gelatina.
- Coloca una hoja de papel dentro de la funda de plástico.
- Enciende los láseres y utiliza las bridas para mantenerlos encendidos.
- Coloca los tres láseres juntos y paralelos entre sí en el borde de la hoja de papel.
- Pon la lente convergente perpendicular a los rayos láser. ¿Qué observas?
- Haz lo mismo con la lente divergente.
- ¿Puedes combinar tus dos lentes para obtener tres rayos de luz paralelos después de haber cruzado las dos lentes?
- Apunta con uno de los punteros láser a un rectángulo de gelatina no cortado utilizando diferentes ángulos. ¿Puedes ver una reflexión? ¿Y difracción? ¿Hay alguna forma de obtener una reflexión total?
📖 Bibliografía y otros recursos
🧑🏫 Explicación
A pesar de ser ambos transparentes, la gelatina solidificada y el aire son medios con diferentes índices de refracción. Cuando el rayo láser procedente del aire llega a la superficie de la gelatina pueden ocurrir dos cosas:
- El rayo cambia su dirección y vuelve al aire, lo que se conoce como reflexión.
- El rayo pasa a la gelatina cambiando un poco de dirección, lo que se conoce como refracción.
Normalmente, tanto la reflexión como la refracción ocurren al mismo tiempo, pero cuando el rayo láser incide en la gelatina con un ángulo mayor que el ángulo crítico, todo el rayo se refleja y nada se refracta.
Este tipo de comportamiento puede observarse en una gran variedad de medios transparentes, como cristales, plásticos, etc., y es lo que permite construir lentes, que son un elemento crucial de gafas, telescopios y microscopios.
9. Reflexión interna total
⏱️ Tiempo de preparación
De 30 min a 1 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Requiere supervisión.
- Uso de láseres.
🧑🍳 Ingredientes
- 1 láser verde.
- 1 vaso transparente.
- 1 hoja de papel.
- Agua.
- Aceite.
📋 Instrucciones
- Llena un vaso transparente con agua y pon un papel encima.
- Apunta el láser a la superficie del agua desde arriba (para evitar el papel, puedes hacer pasar el laser a través del lateral del vaso) y cambia el ángulo de incidencia. ¿Qué observas?
- Apunta ahora el láser a la superficie del agua desde un lado del vaso y desde abajo (la luz debe atravesar el agua antes de llegar a la superficie). Aumenta ligeramente el ángulo de incidencia inclinando el láser. ¿Observas algo especial a partir de cierto ángulo? ¿Qué ocurre con el punto láser en el papel?
- Retira el trozo de papel y pon un poco de aceite en el vaso hasta el punto en que se haya formado una capa de unos 2 o 3 cm por encima del agua.
- Apunta el láser a la superficie del aceite desde arriba y cambia el ángulo de incidencia. ¿Qué observas?
📖 Bibliografía y otros recursos
🧑🏫 Explicación
La luz viaja por el vacío a una velocidad c = 299 792 458 m/s, ¡la máxima velocidad permitida en el universo! Sin embargo, cuando viaja a través de cualquier material (por ejemplo, el agua), su velocidad disminuye un poco. El cociente entre la velocidad de la luz en el vacío y en un material dado se conoce como índice de refracción: n = c/v.
Cuando un rayo de luz pasa de un medio a otro, el cambio de velocidad hace que el rayo se doble, un fenómeno que se llama refracción. Cuando pasa a un medio con un índice de refracción más alto (es decir, cuando se ralentiza), el rayo se dobla hacia abajo. Esto es lo que ocurre cuando la luz viaja del aire al agua. Sin embargo, cuando hace lo contrario, se dobla hacia arriba, tratando de acercarse a la superficie. A un cierto ángulo, el rayo doblado toca la superficie, lo que significa que nada de luz entrará en el segundo material. Esto es lo que llamamos reflexión interna total, y es algo que podemos ver cuando la luz viaja del agua al aire, o del aceite al agua.
Este efecto es bastante útil, ya que nos permite controlar por dónde viaja la luz. Por ejemplo: podemos confinar un rayo láser dentro de un cable y obligarlo a rebotar siempre en las paredes, guiando la luz a través de él. Este es el mecanismo fundamental de la fibra óptica y la razón por la que podemos tener una conexión rápida a Internet en nuestra casa.

10. Velocidad de la luz bañada en chocolate
⏱️ Tiempo de preparación
De 30 min a 1 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Se recomienda supervisión.
- Uso de microondas.
🧑🍳 Ingredientes
- 1 tableta de chocolate.
- Horno microondas.
- Regla.
📋 Instrucciones
- En primer lugar, necesitamos información sobre el horno microondas. Busca una pegatina (normalmente está en la parte trasera) y encuentra la frecuencia de las ondas utilizadas. Estará indicada en megahercios (MHz). ¿Las ondas creadas son ondas viajeras o estacionarias?
- Retira el plato giratorio de tu microondas. ¿Por qué es necesario este paso?
- Coloca la tableta de chocolate en un plato e introdúcela en el microondas. Caliéntala durante 20 segundos a una potencia media-baja. Ten en cuenta que este paso depende de la potencia del microondas. Necesitamos que se derrita sólo una parte del chocolate, ajusta el tiempo si es necesario.
- Con la regla, mide la distancia entre el centro de dos puntos fundidos. esto es la mitad de la longitud de onda (es decir, λ/2), donde λ es la longitud de onda. ¿La posición de las manchas, son nodos o vientres de la onda?
- Utiliza la fórmula c = f · λ, donde f es la frecuencia de las microondas, λ es la longitud de onda y c es la velocidad de la luz.
- Compara tu resultado con el original c = 299 792 458 m/s. ¿Se aproxima tu resultado?
- ¿Podríamos utilizar otro material para medir la velocidad de la luz? ¿Cuál sería la diferencia?
📖 Bibliografía y otros recursos
-
- https://wonders.physics.wisc.edu/measure-the-speed-of-light/
- http://hyperphysics.phy-astr.gsu.edu/hbasees/Waves/standw.html
🧑🏫 Explicación
El fundamento de un microondas es la formación de ondas estacionarias que calientan todo lo que colocamos en él. ¿Qué es una onda estacionaria? Imagina una caja y una onda que viaja de un lado a otro. Cuando la onda llega a la pared, se refleja (“rebota” hacia atrás). Como la onda tiene cierta extensión en el espacio, la onda que viaja hacia atrás interferirá (“colisionará”) con la parte que se mueve hacia delante. Esta interferencia crea una nueva onda, una onda estacionaria, que en lugar de viajar a través de la caja, sólo oscila. Las ondas estacionarias tienen puntos que vibran mucho (vientres) y puntos que no lo hacen (nodos).
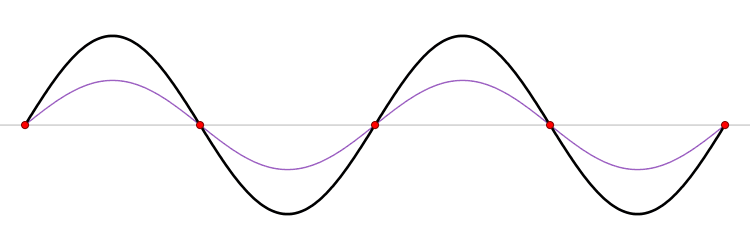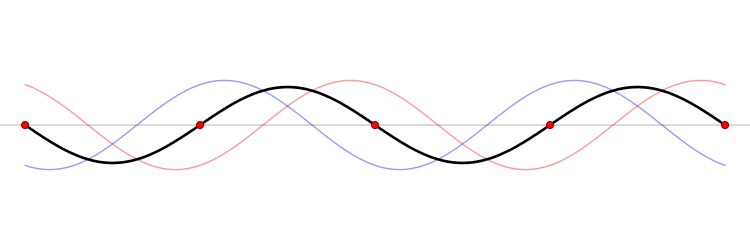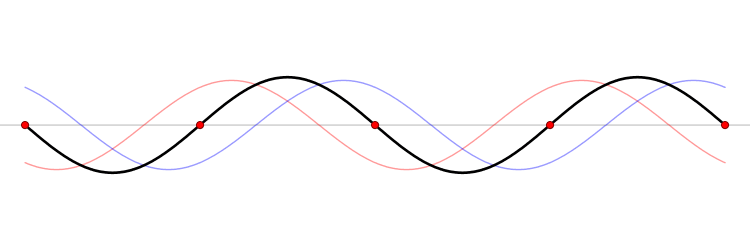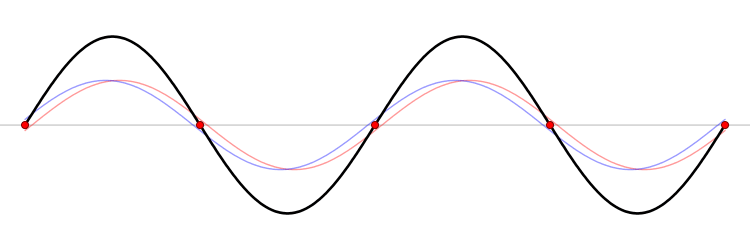
La temperatura es sólo el nombre físico que damos a la energía cinética media de un conjunto de moléculas o átomos. Si las partículas se mueven mucho (alta velocidad) decimos que el objeto está caliente, y viceversa. El microondas calienta la comida porque las moléculas de agua que se sitúan en los vientres de la onda estacionaria, vibran mucho y, por tanto, se mueven rápidamente (empiezan a calentarse).

Las ondas electromagnéticas se mueven a la velocidad de la luz simplemente porque la luz es una onda electromagnética (es una porción de lo que llamamos el espectro electromagnético). La velocidad de una onda se puede obtener si conocemos la frecuencia de la onda y su longitud de onda. Las ondas estacionarias son interesantes porque la distancia entre dos vientres es siempre la mitad de la longitud de onda. Como hemos dicho antes, las moléculas de los vientres se mueven más rápido que el resto, y por tanto si colocamos una tableta de chocolate dentro del microondas, los puntos de los vientres serán los que más se derritan. De este modo, podemos obtener la longitud de onda y, finalmente, la velocidad de la luz. Aquí tienes: un cálculo de una de las constantes más importantes del universo, la velocidad máxima a la que puede viajar un objeto, ¡y un delicioso postre!

PD: Hay que quitar el plato. Si no, la barra de chocolate se movería y la posición relativa de los vientres dentro de la barra de chocolate cambiaría, calentando la barra de chocolate uniformemente.
11. Uva de plasma
⏱️ Tiempo de preparación
De 2 h a 3 h.
🧑🎓 Nivel
Educación Secundaria.
⚠️ Precauciones
- Requiere supervisión.
- Uso de microondas.
- Uso de cuchillo.
🧑🍳 Ingredientes
- 2 uvas.
- Horno microondas.
- Cuchillo.
- Plato no metálico.
- Vaso.
📋 Instrucciones
- Coge una uva y corta los dos extremos para que queden planos.
- Ahora corta la uva en dos, dejando que las dos partes estén unidas por la piel.
- Pon la uva en un plato con los lados abiertos hacia arriba y cúbrela con un vaso.
- Introduce el plato en el microondas y enciéndelo a máxima potencia. Páralo cuando empiece a hacer chispas.
- Coge dos uvas enteras, ponlas en el plato tocándose y cúbrelas con el vaso.
- Repite el paso 4.
📖 Bibliografía y otros recursos
🧑🏫 Explicación
Todos conocemos los tres estados más famosos de la materia: sólido, líquido y gaseoso. Pero, ¿sabías que hay un cuarto estado? ¡El plasma! Se trata de un gas ionizado: las partículas están libres como en un gas, pero algunas de ellas están ionizadas (es decir, algunos electrones se escapan de los átomos, dejando un núcleo positivo). La forma más habitual de producir plasma es calentándolo, lo que da a los electrones suficiente energía para escapar de su atracción al núcleo del átomo. Así es como creamos fuego, uno de los ejemplos más cotidianos de plasma.
 en [Unsplash](https://unsplash.com).](/blog/2022/04/24/gastrofisica/fuego_huf33ca4b9a9aecc9ab15b6e35f348b5a5_284618_df9375bc54aa10535dba6c485173537b.webp)
El microondas utiliza un magnetrón para producir ondas electromagnéticas llamadas “microondas”, que son reflejadas por las paredes metálicas del horno y absorbidas por los alimentos. Al ser absorbidas, las microondas hacen vibrar las moléculas de agua de los alimentos aumentando su temperatura.

Las ondas electromagnéticas se comportan de forma especial cuando encuentran objetos del tamaño de la longitud de onda, que en el caso de las microondas es de unos centímetros. Como la piel de la uva que une los dos trozos tiene ese tamaño, crea un punto caliente. En estos puntos calientes, el potasio y sodio presentes en la piel de la uva se ionizan. Este efecto combinado con las ondas electromagnéticas producidas por el horno de microondas puede dar lugar a una cascada de ionización de las moléculas de aire circundantes, dando lugar al plasma que observamos.

Et voilà! Con este experimento, puedes crear tu propio plasma, ¡la misma fase de la materia en la que vive el Sol!
En el artículo citado en la bibliografía, puedes encontrar vídeos a cámara lenta de este fenómeno que puede ser replicado en otros esferoides como las perlas de hidrogel.

Discord
Participa activamente en la web comentando, dando tu opinión, realizando peticiones, sugerencias...